問世5年,“阿爾法折疊2”深刻影響生命科學




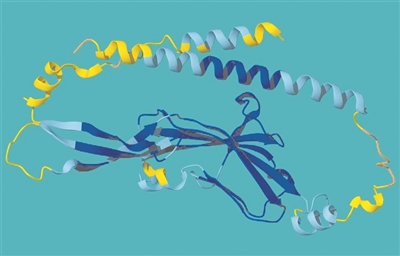 “阿爾法折疊2”預測的Tmem81的模型,是一種參與卵子與精子融合的膜蛋白。圖片來源:“深度思維”公司/歐洲分子生物學實驗室
“阿爾法折疊2”預測的Tmem81的模型,是一種參與卵子與精子融合的膜蛋白。圖片來源:“深度思維”公司/歐洲分子生物學實驗室 2020年,谷歌旗下“深度思維”公司推出人工智能模型“阿爾法折疊2”。如今,它已能預測幾乎所有已知的兩億多種蛋白質結構,將人工測定蛋白質結構的時間從數年縮短至幾分鐘,展現出AI推動科學發展的巨大潛力。
英國《自然》網站在近日的報道中指出,問世5年來,“阿爾法折疊2”不僅改變了結構生物學的研究方式,也推動了計算生物學的進步。不過,將其生物學洞見轉化為藥物開發等實際應用仍需時間。
助力科研探索
“阿爾法折疊2”已在眾多科學場景中得到應用。
奧地利維也納分子病理研究所安德烈亞·泡利團隊長期研究精子與卵子如何結合。2018年,他們發現斑馬魚卵表面的Bouncer蛋白對受精至關重要,卻無法解析其識別精子的機制。
“阿爾法折疊2”的出現帶來轉機。模型預測,一種名為Tmem81的蛋白會與兩種精子蛋白形成復合物,并與Bouncer結合。實驗很快驗證了這一結果。
泡利表示,“阿爾法折疊2”顯著加快了研究進程,“我們現在每個項目都會用到它”。2024年,團隊發表了相關論文。這篇論文是引用《自然》雜志發表的“阿爾法折疊2”原始論文的近4萬篇之一。2021年7月,“深度思維”開源了這一模型,并在《自然》上發文詳述其方法。
與其他高被引論文不同,科學界對“阿爾法折疊2”的關注至今未減。
研究人員認為,其迅速普及的關鍵在于開放共享。“深度思維”不僅公開了算法代碼,還與歐洲分子生物學實驗室合作建立了“阿爾法折疊數據庫”,目前已收錄超過2.4億個結構預測,覆蓋絕大多數已知蛋白質,為全球100多個國家的330萬名研究者提供支持。
重塑學科面貌
“阿爾法折疊2”影響最深的領域,莫過于結構生物學。歐洲生物信息學研究所的珍妮特·桑頓指出,它“重塑了結構生物學的面貌”。
數據顯示,使用“阿爾法折疊2”模型的研究人員,向蛋白質數據庫提交結構的數量比未使用者高出約50%,提交率也優于使用其他AI方法或傳統技術的團隊。
更令人欣喜的是,這個基于蛋白質數據庫訓練的模型,正在反哺實驗科學。“阿爾法折疊2”的開發者約翰·江珀強調,預測結構能幫助研究人員解析X射線晶體學和冷凍電鏡獲得的實驗數據,這對原本為其提供訓練數據的研究者尤為有益。
計算生物學也借此迎來新發展。桑頓觀察到,如今學術會議上幾乎每個報告都會提及“阿爾法折疊2”。在直接引用它的文獻中,AI輔助藥物研發、蛋白質設計等方向尤為突出。
美國哥倫比亞大學計算生物學家穆罕默德·阿爾庫賴希坦言,“阿爾法折疊2”問世之初,不少同行曾經歷“生存危機”,擔心蛋白質結構預測這一核心問題已被徹底解決。但事實上,它開辟了更多創新賽道,AI蛋白質設計就是其中之一,不僅激發了新的研究熱情,也吸引了更多資金投入。
如今,科學家已利用“阿爾法折疊2”設計應對抗生素耐藥性的方案、尋找瘧疾等疾病的新療法,并深入理解疾病機制、加速靶向藥物開發。
應用潛力巨大
直接引用論文或使用數據庫,僅是“阿爾法折疊2”影響力的冰山一角。
英國倫敦創新增長實驗室科學家喬治·理查森與大衛·安普迪亞·文森特綜合分析發現,超過20萬項研究、近80萬名科學家直接或間接受益于“阿爾法折疊2”。
不過,當他們試圖量化其具體影響時,卻發現情況復雜:實驗室論文產出增幅約為5%,個人研究者僅高出2%。理查森指出,“阿爾法折疊2”并未催生“論文工廠”,其價值體現在更深層次。
在臨床與商業轉化方面,影響同樣多元。可能因為5年時間尚短,還不足以充分體現在專利等成果中。江珀也認為,將生物學見解轉化為實際應用需要時間積累。
2024年,“阿爾法折疊3”正式發布,其在藥物發現領域潛力更大,能夠預測潛在藥物與蛋白質的相互作用。
江珀強調,基于“阿爾法折疊2”的發現已在幫助科學家揭示疾病機制,未來,必將有患者因這項技術重獲健康。
本文鏈接:http://knowith.com/news-3-4611.html問世5年,“阿爾法折疊2”深刻影響生命科學
聲明:本網頁內容由互聯網博主自發貢獻,不代表本站觀點,本站不承擔任何法律責任。天上不會到餡餅,請大家謹防詐騙!若有侵權等問題請及時與本網聯系,我們將在第一時間刪除處理。