藥學院肖百龍課題組揭示機械力受體PIEZO離子通道的力學門控新機制




清華新聞網12月4日電 機械門控PIEZO離子通道是生物體內一類關鍵的機械力受體,能將機械力刺激轉化為細胞的電化學信號。它們參與介導多種核心的生理過程,與多種人類疾病密切相關。
近日,清華大學藥學院肖百龍教授課題組報道了PIEZO通道如何憑借一種“彈簧樣”結構元件與力學機制,精準調控其快速激活與失活,并決定其隨機性的單通道開放與關閉的電生理特性。該工作不僅深化了對PIEZO通道工作機制的理解,而且提出了離子通道在單分子水平的“隨機性”行為由其內在結構機制決定的新觀點。
在全細胞電生理記錄模式下,PIEZO1通道能夠快速響應機械力刺激并產生宏觀電流(圖D中mPIEZO1藍線部分),隨后迅速衰減進入失活狀態(圖D中mPIEZO1紅線部分)。而在單通道水平,PIEZO1則表現出反復隨機的開放與關閉行為(圖D中mPIEZO1左下)。值得注意的是,在持續機械力刺激下,這種單通道的開放與關閉行為持續存在且無明顯失活,呈現典型的“隨機性”單分子行為。
研究團隊進一步利用果蠅PIEZO通道與小鼠PIEZO1通道在電生理性質上的顯著差異(圖D,dPIEZO),構建了二者連接器互換的嵌合體載體。實驗發現,連接器的互換導致了相應電生理特性的互換。通過系統性的定點突變及電生理功能驗證,研究確定了OC-linker兩端的特定氨基酸殘基(I2213和D2225)以及S-linker上的S-helix結構和G2465鉸鏈位點共同參與調控通道的失活與激活過程(圖D)。
通過引導分子動力學模擬(steered molecular dynamics, SMD)、計算及結構分析,研究團隊發現OC-linker和S-linker在門控過程中表現出熵彈簧的特性。定量分析表明,三對OC-linker和S-linker在門控過程中所需的總能量約為4.8kBT,接近環境熱能的量級。
綜上,該研究提出了PIEZO通道失活和隨機單通道門控的彈簧樣力學作用機制。該機制的核心在于,OC-linker和S-linker作為熵彈簧,位于通道頂部的帽狀結構與跨膜孔道之間。當機械力使帽狀結構下移、槳葉區展平時,連接器從伸展的高熵狀態轉換為壓縮的低熵狀態,儲存彈性勢能,從而打開孔道,引發通道激活;隨后,被壓縮的連接器傾向于恢復其伸展狀態,將帽狀結構推回,促使帽狀結構閘門關閉,通道快速失活。而在環境熱力學擾動下,處于上移狀態的帽狀結構和伸展的連接器能再次下移和壓縮,重新打開帽狀結構閘門,使通道再次開放。這種彈簧式的壓縮-釋放機制使通道在穩態張力和環境熱能作用下能實現可重復的開啟-關閉循環,并決定了其隨機而可控的單通道開關特性(圖A、B)。
該研究揭示的PIEZO通道基于“彈簧樣”連接器的力學機制可能普遍適用于多種離子通道的門控過程。研究團隊進而提出新觀點,認為離子通道在單分子水平的“隨機性”開放與關閉行為是由其內在結構機制所決定的。
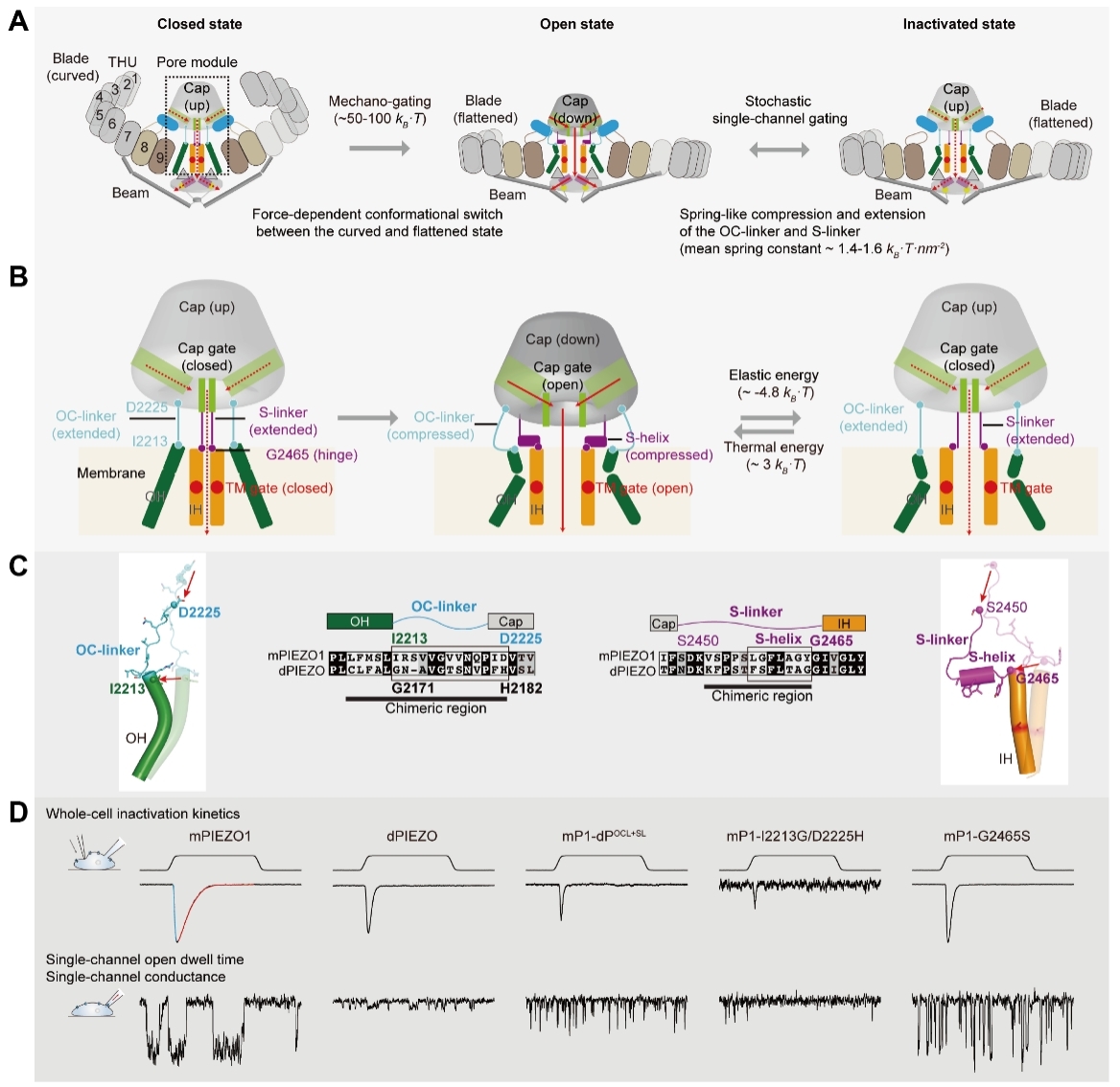
PIEZO通道門控過程、“彈簧樣”門控機制、連接器結構序列和電生理性質
研究成果以“機械門控PIEZO通道以一種彈簧樣的力學機制實現快速失活和隨機性的單通道門控”(Spring-like mechanics enable rapid inactivation and stochastic single-channel gating of the mechanically activated PIEZO channel)為題,以研究長文形式于11月26日發表于《細胞報告》(Cell Reports)。
清華大學藥學院教授肖百龍為論文通訊作者,肖百龍教授課題組2025屆博士畢業生劉文豪為論文第一作者。
研究得到國家科技部2030科技創新-“腦科學與類腦研究”重大項目、新基石研究員項目、北京市卓越學者項目和深圳市醫學研究專項等的支持,同時得到清華-北大生命科學聯合中心、北京市生物結構前沿研究中心、膜生物學國家重點實驗室和清華-IDG/麥戈文腦科學研究院的支持。
本文鏈接:http://knowith.com/news-3-4587.html藥學院肖百龍課題組揭示機械力受體PIEZO離子通道的力學門控新機制
聲明:本網頁內容由互聯網博主自發貢獻,不代表本站觀點,本站不承擔任何法律責任。天上不會到餡餅,請大家謹防詐騙!若有侵權等問題請及時與本網聯系,我們將在第一時間刪除處理。